A nukleáris kölcsönhatás
Előzmény:
Az atommag főbb tulajdonságai:
az atommmag töltése , rendszám: Z
tömegszám ( protonok és neutronok száma ): A
az atommag mérete ( sugara ) :  , ahol
, ahol 
Kérdés: mi tartja össze az atommagot?
A nukleonok minimális kinetikus energiája az atommagon belül ( a becslést a határozatlansági relációval tesszük meg ):
Itt  szóras nagyságrendileg egyezik a nukleon impulzusával :
szóras nagyságrendileg egyezik a nukleon impulzusával : 
Ennélfogva :
E ≥  , ahol m a nukleon tömege :
, ahol m a nukleon tömege : 
ahol  az elektron tömege.
az elektron tömege.
E ≥ 1MeV
A gravitációs túl gyenge, attól kb. 35 nagyságrenddel nagyobb energia jöhet csak szóba.
Igen magas a nukleonok kinetikus energiája, mégis kötve vannak. Kell lennie egy ennél erősebb kölcsönhatásnak, ennek a neve:
Nukleáris kölcsönhatás
A kölcsönhatás energiája abszolút értékben nagyobb, mint 5MeV, mert a mag kötött rendszert alkot.
(Kötött rendszer: összenergiája negatív.)
Ez a harmadik kölcsönhatásfajta. (Az első kettő a gravitációs és az elektromágneses, a negyedik az un. gyenge kölcsönhatás lesz - későbbiekben . Jelenleg ezt a négy kölcsönhatást fogadja el a tudomány, de ez a jövőben változhat - az aktuális ismeretek birtokában.)
A nukleáris kölcsönhatás tulajdonságai:
1) Nagyon erős vonzó kölcsönhatás (a másik nevét ezért kapta: erős kölcsönhatás).
2) Nukleonok között hat: az n-n, p-p, n-p kölcsönhatások ugyanolyan erősek.
De az erős kölcsönhatás spinfüggő. Az első és második pár sohasem alkot kötött rendszert, mert spinjeik ellentétes irányba mutatnak, de a harmadik pár (a deutérium) létezik, mert a Pauli-elv nem zárja ki, hogy a protonok és neutronok ugyanazt az állapotot egyező spinnel betöltsék.
3) Nagyon rövid hatótávolságú kölcsönhatás (gyakorlatilag csak a szomszéd - egymással érintkező nukleonok hatnak így kölcsön). A nukleáris kölcsönhatás telített: bizonyos hatásgömbön belüli nukleonokat kell csak figyelembe venni a kölcsönhatás során. (Hasonlít a Van der Waals kölcsönhatáshoz.)
4.) Másodlagos erő, mint a Van der Waals erő, amely az atomon belüli töltések kölcsönhatásának maradéka, ami a semleges atomok között lép fel. Ez a kölcsönhatás a nukleonokat alkotó részecskék a kvarkok kölcsönhatásának maradéka
Kötési energia: Ek
Az az energianagyság, amivel össze vannak kötve a nukleonok. Az atommag energiájának és az azt alkotó nukleonok energiájának különbsége. Ezt az energiát kell befektetni, hogy kiszabadítsuk a nukleont az atommagból.
Kötési energia és tömegdefektus / tömeghiány /
Legyen M(A,Z) A tömegszámú, Z rendszámú atom atommagjának a tömege.
Legyen  a proton tömege,
a proton tömege,
Dm : tömegdefektus : a protonok és neutronok egyesítésekor felszabadult energia eltávozott, és elvitt egy bizonyos tömeget.
Tömegspektrométerrel az atommagok tömege mérhető, így a tömegdefektus is meghatározható.
A relativitáselméletbõl következik: 
A magok többségére a kötési energia a tömegdefektusból határozható meg.
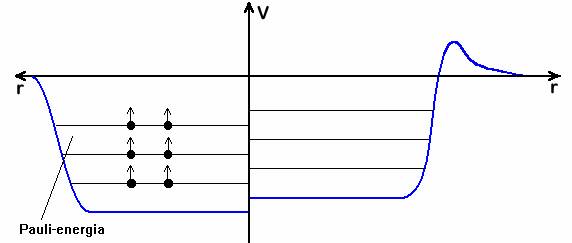
A potenciálkád modell (kvalitatív modell a potenciál helyfüggésére)
A nukleáris kölcsönhatáshoz pontos analitikus függvényt nem tudunk rendelni.
Közelítés: átlagos potenciáltér, amelyben a nukleonok mozognak.
Töltött folyadékcsepp modell (Weizsäcker) (kvantitatív modell a kötési energiára)
Alapötlet: a maganyag hasonlít a folyadékra, mert a nukleáris kölcsönhatás és a Van der Waals kölcsönhatás hasonló jellegű.
Minden atommagnak ugyanaz a sűrűsége (mint ahogy a folyadékcseppnek sem függ a sűrűsége a méretétől).
(  )
)
Különbség: A magot alkotó részek töltöttek, és feles spinűek. (Pauli-elv érvényes rájuk)
(  ==>
==>  ;
;  )
)
A kötési energia képlet első két tagja u.o. alakú, mint a folyadékcsepp energiája (csak nyilván sok nagyságrenddel nagyobb energiákról van szó).
A magban lévő nukleonok a szomszéd nukleonok potenciálterében vannak:
A felületen lévőknek kevesebb a szomszédja
A protonok töltése miatt azonban elektrosztatikus energia is van
Az eddigi energiatagokat a klasszikus fizika alapján magyaráztuk. A többit már csak a kvantummechanika tudja.
Ha csak az első 3 energiatag lenne, akkor a mag csak neutronokból állna. De a Pauli-elv miatt a később betett neutron részére már csak magasabb szintek állnak rendelkezésre. Így a Coulomb taszítás ellenére a protonok is beépülnek.
Minél jobban eltér a proton- és a neutronszám, annál eltérőbb energiaszintekre épülnek be.
másrészt  -vel arányos 1 db. nukleon többletenergiája ;
-vel arányos 1 db. nukleon többletenergiája ;
harmadrészt az A a nevezőben van, mert nagyobb magban sűrűbbek az energiaszintek)
|h| , ha a mag proton- és neutronszáma páratlan - páratlan (igen ritka a természetben, csak a periódusos rendszer elején fordul elő (2H,6Li,10B,14N)
h = 0 , ha a mag proton- és neutronszáma közül az egyik páros a ásik páratlan (45+51 fajta)
-|h| , ha a mag proton- és neutronszáma páros - páros (igen gyakori a természetben (141 fajta))
Páratlan rendszámú elemeknek páros tömegszámú izotópjai a természetben nem nagyon valósulnak meg (mert az páratlan - páratlan).
A nukleonokra érvényes az anti-Hund szabály: a nukleonok szeretnek egyforma térbeli állapotokat betölteni, mert így tudnak legközelebb lenni egymáshoz. (Ha egy bizonyos állapotot egy proton vagy neutron már betölt, egy ugyanolyan nukleon ellentétes spinnel szívesen csatlakozik hozzá.)
A nukleáris kölcsönhatás vonzó és erősebb, mint az elektrosztatikus kölcsönhatás.
a, b, g, d, h konstansok a mérési eredményekre való illesztéssel határozhatók meg, ezért a képletet gyakran nevezik "félempirikusnak".
Egy nukleonra jutó kötési energia:
A legjobb illesztéshez tartozó paraméterek:
a=15,75 MeV
b=17,8 MeV
g=0,7 MeV
d=94,8 MeV
h=34 MeV
A görbe jellemzői:
1., Az illesztés nagyon jó, kivéve a nagyon könnyű elemeket és néhány mágikus számot: Z, vagy A-Z=2,8,20,50,82,126
Oka: Ezek a magban lezárt nukleonhéjakat jelentik, amelyet a folyadékcsepp modell nem vesz figyelembe.
2., Optimális e nagyjából A ~50 környékén:
Ha A<<50, akkor túl nagy a felületi energia (túl sok nukleon van a felületen.)
Ha A>>50, akkor túl nagy a Coulomb energia
3.,Különösen erős kötés van a  és az
és az  esetében
esetében
(4=2+2, 16=8+8 => ezek kétszer mágikusak)
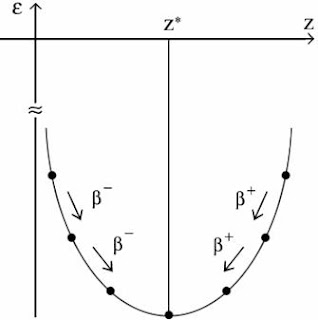
A b bomlás magyarázata:„A” adott és páratlan
A parabola alján levõ atommagok stabilisak és az atomok igyekeznek b bomlással a parabola mélyére jutni.
b- : negatív b bomlás:
Ez magában álló neutronnal is megtörténik.
b+ : pozitív b bomlás:
Ez csak atommagban történhet meg, magában nem.
A b bomlás beállítja az optimális proton – neutron arányt.
A b bomlásért felelõ kölcsönhatás az ún. gyenge kölcsönhatás. Ez a 4. kölcsönhatási forma a természetben. /nincs több/
A Z*(A) függvény:
A görbevonal feletti nukleonok b+ bomlók, míg az alattiak b- bomlók. Így juthatnak a stabil vonalra.
Az a-bomlás magyarázata
T* : az a részecske kinetikus energiája az atommagon belül.
T* + V > 0, ezért alagúteffektussal az a részecske kijuthat az atommagból.
Ta : az a részecske kinetikus energiája az atommagtól távol.
A kijutás valószínűsége a bevonalkázott területtõl függ igen erõsen.
4 MeV < Ta < 9 MeV
A gát annál kisebb, minél nagyobb a részecske kinetikus energiája, ezért a kilépés valószínűsége és a felezési idő is az energiától függ.
Ha Ta @ 4 MeV T1/2 @ 109 év
T a @ 9 MeV T1/2 @ 10-8 s