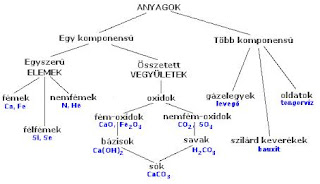
Kémiai elemek
Azonos rendszámú atomokból felépülő anyagokat kémiai elemeknek nevezzük. Jelenleg 104 elemet ismerünk, ebből 90 természetes 14 mesterséges. Az elemeket a periódusos rendszer tartalmazza, ami biztosítja a könnyű áttekinthetőséget. Leggyakrabban legnagyobb mennyiségben (az élő szervezetben is) az oxigén fordul elő.
Az elemek előfordulhatnak:
- szabadon (nemesgázok);
- kötött állapotban:
- fémes elemek (ezek fémes kötésűek), vegyérték elektronjuk száma kevés, elekt-ronaktivitásuk kicsi (0,9 – 1,5), elektronjukat könnyen leadják és fémes kötéssel összekapcsolódnak. Tulajdonságuk: szilárdak (kivéve a higany), fémrácsosak (kivéve a hidrogén), az áramot vezetik.
- nemfémes elemek, vegyérték elektronjuk száma háromnál több, elektronaktivitá-suk 2,5-nél nagyobb, inkább felvesznek elektront, mint leadnak, így kovalens kötésre hajlamosak, és kétatomos elemi molekulákká alakulnak. Tulajdonságuk: gázok (H2, O2, N2, F2, Cl2, Br2 (folyadék), I2, nincs több 2 atomos elem), mole-kularácsosak (a szilárd halmazállapotban).
- átmeneti elemek, elektronegativitásuk 1,8 – 2,5, ezzel több atomos elemi mole-kulát alkotnak. Tulajdonságuk: szilárdak, nagykeménységűek, atomrácsosak, az áramot nem vezetik (P4, S8), a B P vonal két oldalán található elemek, pl. a C gyémánt változata, Si, Te, Po
Vegyületek
Különböző rendszámú atomokból épülnek fel.
Kötéstípus szerint kétfélék lehetnek:
- ionkötésű vegyületek, tulajdonságuk: ionkristályosak (erős kémiai kötés), szilárdak, ol-vadáspont magas, keménysége nagy. Vizes oldatuk vezeti az áramot.
- kovalens kötésű vegyületek, rácstípus szerint kétfélét különböztetünk meg:
- molekularácsosak; gázok (CO2, NH3), folyadék (H2O), szilárd (cukrok). Tulajdonsá-guk: olvadáspontjuk alacsony, keménységük kicsi az áramot nem vezetik.
- atomrácsosak; Tulajdonságuk: szilárdak, nagykeménységűek, vízben oldhatatlanok, az áramot nem vezetik.
Atomok mérete: az atomok méretét az atomsugárral fejezzük ki, kétféleképpen határozhatjuk meg:
- szabad atomoknál és szabad ionoknál annak a gömbnek a sugara, amelyen belül az elektronok 90%-a megtalálható;
- kötött atomoknál a kötésben lévő azonos atomok magjai közötti távolság fele. Mértékegysége az nm (nanométer, 10-9m), értéke 0,03 – 0,244 nm között van. A perió-dusos rendszerben balról jobbra az értéke csökken, mert nő a magok vonzása, lefelé nő, mert nő az elektron héjak száma.
Ionsugár:
- pozitív ionoknál kisebb, mint az eredeti atomoknál, mert a kevesebb elektront a protonok erősebben vonzzák és fordítva;
- negatív ionoknál nagyobb, mint az eredeti atomoknál, mert a több elektront a pro-tonok gyengébben vonzzák.



Megjegyzés küldése