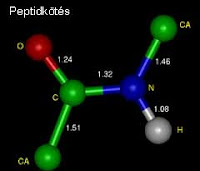
Telített szénhidrogének
A telített nyílt láncú szénvegyületeket az érvényes nevezéktan szerint alkánoknak nevezzük. Hagyományosan paraffinoknak nevezték őket.
Alkánok
 A növekvő szénatomszámmal fokozatosan növekszik a forráspont értéke. Az olvadáspont is emelkedik a szénatomszámmal. Az alkánok apoláris molekulák vízben nem oldódnak. Oldódásuk csak apoláris oldószerben várható, a cseppfolyós alkánok (benzin) oldják a szilárd halmazállapotúakat.
A növekvő szénatomszámmal fokozatosan növekszik a forráspont értéke. Az olvadáspont is emelkedik a szénatomszámmal. Az alkánok apoláris molekulák vízben nem oldódnak. Oldódásuk csak apoláris oldószerben várható, a cseppfolyós alkánok (benzin) oldják a szilárd halmazállapotúakat.Kémiai sajátosságaik: Elegendő levegő jelenlétében szén-dioxiddá és vízzé égnek el. A reakció mindig exoterm – hőtermelő – éppen ezért használják energiatermelésre.
Hőbontás: A szénhidrogének kötései magasabb hőmérsékleten felhasadnak, ezeket a kémiai változásokat iparilag is kihasználják.
Krakkolás: A krakkolás enyhe hőbontási folyamatot jelent, amikor nagyobb szénatomszámú szénhidrogének szénláncából „letörnek”, és így rövidebb szénláncú szénhidrogéneket nyernek.
Szubsztitúiós reakció: A szusztitúció olyan kémiai folyamat, amelynek során a kiindulási molekula egy vagy több hidrogén atomját más atomra cserélik ki.
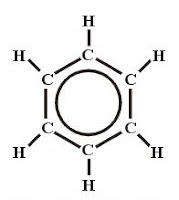 Cikloalkánok: A telített (csak egyszeres kötést tartalmazó) gyűrűs szénhidrogéneket cikloalkánoknak nevezzük. A cikloalkánok is homológ sort alkotnak, amelynek általános összegképlete: CnH2n. Elnevezésük az alkánokéhoz hasonló, csak a megfelelő szénatomszámú név elé a „ciklo” szót tesszük. Fizikai és kémiai tulajdonságaik nagyon hasonlítanak a nekik megfelelő szénatomszámú alkánok tulajdonságaihoz.
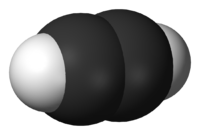
Cikloalkánok: A telített (csak egyszeres kötést tartalmazó) gyűrűs szénhidrogéneket cikloalkánoknak nevezzük. A cikloalkánok is homológ sort alkotnak, amelynek általános összegképlete: CnH2n. Elnevezésük az alkánokéhoz hasonló, csak a megfelelő szénatomszámú név elé a „ciklo” szót tesszük. Fizikai és kémiai tulajdonságaik nagyon hasonlítanak a nekik megfelelő szénatomszámú alkánok tulajdonságaihoz.Metán CH4: A metán a legegyszerűbb szénhidrogén. A metán színtelen, szagtalan gáz. Apoláris szerkezetéből következően vízben nem, apoláris oldószerekben oldódik. Magasabb hőmérsékleten többféle kémiai reakcióban vesz részt, és jelentős, mint vegyipari alapanyag. Energiatermelésre nagy égéshője miatt alkalmas CH4+2O2®CO2+2H2O. Standard állapotban nem reagál az oxigénnel, de levegővel elegyedve már szikrának a hatására is robban.
Szobahőmérsékleten a klór nem reagál a metánnal, de ultraibolya fénnyel megvilágítva vagy 400-500 C°-ra felmelegítve a reakció megindul, és katalizátor nélkül végbemegy. Klórozása iparilag is fontos szubsztitúciós reakció CH2CL2+CL2®CHCL3+HCL (kloroform). A metán hőbontása, levegőtől elzárt hevítést jelent. CH4®C+2H2 (gumigyártás).
Előfordulás: A földgáz legnagyobb mennyiségben metánt tartalmaz, ma gyakorlatilag a földgázból nyerik.
Felhasználás: Energiaforrás, vegyipari alapanyag.
Telített szénhidrogének (alkánok, parafinnok)
A telített szénhidrogének alkothatnak elágazás nélküli láncot (nyílt szénhidrogének), elágazást tartalmazó láncot és gyűrűvé (zárt) is záródhatnak. Az alábbiak elsősorban az elágazás nélküli, nyílt szénhidrogénekre vonatkoznak.
Elnevezés: az alkánok neve mindig -án szótagra végződik.
1. Sorold fel az első tíz alkánt, ad meg szerkezeti- és összegképletüket!
2. Ismételd át, hogyan alakul ki a kovalens kötés!
 Fizikai tulajdonságaik: a nyílt láncú, elágazás nélküli, telített szénhidrogének apolárisak. A butánig gáz, az oktadekánig folyadék, a magasabb szénatomszámúak szilárd halmazállapotúak.
Fizikai tulajdonságaik: a nyílt láncú, elágazás nélküli, telített szénhidrogének apolárisak. A butánig gáz, az oktadekánig folyadék, a magasabb szénatomszámúak szilárd halmazállapotúak.Kémiai tulajdonságaik: elektronszerkezetük nagyon kiegyensúlyozott, sem elektronhiányuk, sem elektromfeleslegük nincs a molekulán belül. Ennek megfelelően nem túl reakcióképes vegyületek.
A metán ultraibolya fény hatására reagál halogénekkel. Egyik hidrogénjét halogénre cseréli.
CH4 + Cl2 = CH3Cl + HCl
A kémiai átalakulás neve: szubsztitúció. Az olyan kémiai átalakulásokat, amelyek eredményeként a kiindulási molekula egyik atomja vagy atomcsoportja más atomra vagy atomcsoportra cserélődik ki szubsztitúciónak nevezzük.
Meggyújtva a levegő oxigénjével tökéletes égés mellett reagálnak. A reakció neve: oxidáció.
CH4 + 2O2 = CO2 + 2H2O
A paraffinok vízben gyakorlatilag nem oldódnak.
Előfordulásuk: földgáz, kőolaj
Felhasználásuk: energiaforrások
Érdemes meglátogatnod az alábbi oktatási oldalakat!
Metán, telített szénhidrogének.
Kiegészítés:* a szénláncok elágazásokat, oldalláncokat is tartalmazhatnak. Tulajdonságaik megismerése előtt szükséges a csoport fogalmának megismerése, amely így hangzik: a mulekula általunk tetszőlegesen körülhatárolt egy-egy részlete. Ha a csoport csak egy hidrogénatommal tartalmaz kevesebbet, mint egy alkánmolekula, akkor úgy nevezzük el, hogy az azonos szénatomszámú alkán nevének -án végződését -il végződéssel helyettesítjük. Pl: metil-csoport -CH3.
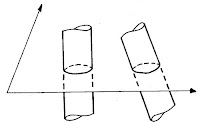
Két vagy három szénatom csak egyféleképpen kapcsolódhat lánccá, négy szénatom kapcsolódására azonban már két lehetőség van. Az azonos összegképletű, de különböző szerkezetű molekulákat egymás konstitúciós izomerjeinek nevezzük. (A molekulát felépítő atomok kapcsolódási sorrendjét a molekula konstitúciójának nevezzük.) Nézzük meg a jelenséget a bután példáján! Ha nem ágazik el a szénlánc a vegyület neve: bután, ha közepén van egy elágazás izomerje a butánnak, elnevezése: izobután.
Balra bután, jobbra izobután. |
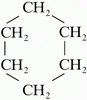
Abban az esetben, ha a szénlánc gyűrűvé záródik a szénhidrogénlánc neve elé illesztjük a ciklo szócskát. Pl.: ciklopropán, ciklobután... A képen a ciklohexán látható. Sok olyan természetes és mesterséges vegyületet ismerünk, amelynek molekuláiban a szénatomok többgyűrűs vázat alkotnak. Ezek közül most a szteroidokat említjük meg, melyek közös "alapvegyülete" a szteránváz (más néven gonán).