Oxigéntartalmú vegyületek:
Azok a molekulák amelyek szén- és hidrogénatomokon kívül oxigénatomot is tartalmaz.Ilyen anyagok pl. az alkoholok, a zsírok, az olajok, a cukrok,a keményítő. Ezek többféle funkciós csoportot képezhetnek.
Alkoholok és fenolok:
A hidroxilcsoportot tartalmazó vegyületeket hidroxilvegyületeknek nevezzük: alkoholok, fenolok.
Alkoholok:
Többféle szempontból lehet az alkoholokat csoportosítani:- a hidroxilcsoportok száma
- a szénlánc felépítése és
- a hidroxilcsoportok helyzete szerint.
A szénlánc felépítése szerint megkülönböztetünk:telített és telítetlen, nyílt láncú és gyűrűs alkoholokat. A rendűség attól függ, hogy az a szénatom, amelyikhez a hidroxilcsoport kapcsolódik, hány vegyértékével kötődik más szénatomokhoz. ALKANOL ált. képlete: CnH2n+1-OH vagy R-OH.
A fenol:C6H5OH
A fenolok molekuláiban a hidroxilcsoport(ok) aromás gyűrűhöz kapcsolódnak. A fenol színtelen, jellegzetes szagú, kristályos anyag. C6H5 –OH + H2Oà C6H5O - + H3O+ . Mérgező hatású anyag.Festékek, gyógyszerek, növényvédő és fakonzerváló szerek gyártása.
Metanol (metil-alkohol, faszesz)CH3OH:
A fa száraz lepárlásával állították elő.Színtelen, jellegzetes szagú folyadék.Vízzel korlátlanul elegyedik.Rendkívül veszélyes, mérgező anyag.
Etanol (etil-alkohol,borszesz)C2H5OH:
Tiszta szesz 96%-os töménységű. A vízmentes 100%-os alkohol neve abszolút alkohol. Az etanol vízzel korlátlanul elegyedik, jól oldja az apoláris molekulájú olajokat, zsírokat is.Meggy kékes lánggal ég, szén-dioxiddá és vízzé alakul.C2H5 – OH + 3 O2 à2 CO2 + 3 H2O. Az alkohollal működtetett autók kevésbé szennyezik a levegőt, mint a benzinnel működők.A vegyipar számára fontos anyag.Használják oldószerként, motorbenzin minőségének javítására, kokpogásgátló anyagként és más anyagok előállítására is.70%-os oldata fertőtlenítőszer.Az alkoholokat gyakran denaturálják. A denaturált szeszt gyakran spiritusznak vagy borszesznek is nevezik.Erjesztéssel legfeljebb 15%-os alkohol- oldaz állítható elő,mert az ennél töményebb oldatban az élesztőgombák elpusztulnak.Toményebb oldat a 15%-os vizes oldat lepárlálásával(desztillálásával) nyerhetünk Az így kapott tiszta szesz 96%-os.
Glikol(többértékű):
A glikol kétértékű alkohol.Kémiai neve: etán 1,2-diol.Színtelen, sűrűn folyó, édes ízű folyadék. Vizes oldata a fagyálló.
Glicerin(többértékű):
A glicerin háromértékű alkohol. Kémiai neve: propán- 1,2,3-triol.
Színtelen sűrűn folyó, édes ízű folyadék. Erősen nedvszívó. Higroszkópos tulajdonsága miatt a kozmetokai iparban hidratáló krémek készítésére használják. Sok glicerint használnak robbanóanyagok(dinamit) gyártására. A dinamitot Alfred Nobel találta fel 1867-ben.A glicerin az állati zsírok és a növényi olajok alkotórésze; előállítása is zsiradékokból történik.
Éterek:
Az etanol molekuláiból vízkilépéssel éter keletkezik.
A két alkoholmolákulából egy molekula víz lép ki.Az éter színtelen, bódító szagú folyadék. Gyorsan párolog.. Nem elegyedik vízzel.Rendkívül tűzveszélyes anyag, gőze a levegővel keveredve robbanó elegyet képez.
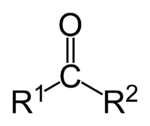
Aldehidek(oxovegyületek):
Azokat az oxovegyületeket , amelyek molekulái láncvégi szénatomhoz kapcsolódó oxigénatomot tartalmaz, aldehideknek nevezzük.Ált képl.: A hidrogénelvonást dehidrogénezésnek nevezik:
Az aldehidek könnyen redukálódnak:
Metanol, formaldehid (HCHO):
Színtelen szúrós szagú gáz. Vízben jól oldódik, 30-40%-os vizes oldata a formalin,melyet fertőtlenítésra, állatpreparátumok, biológiai készítmények konzerválására használnak.
Etanal, acetaldehid(CH3-CHO):
Színtelen, kellemetlen szagú folyadék.Az etanolból keletkezik hidrogénleadással.
Ketonok:
Azokat a vegyületeket amelyek láncközi másodrendű szénatomhoz kapcsolódó kettős kötésű oxigénatomot tartalmaznak ketonoknak nevezzük. Ált. jel.:R-CO-R.A ketonok a másodrendű alkoholokból származtathatók hidrogénelvonással, oxidációval. A ketonok kevésbé reakcióképesek, mint az aldehidek. A ketonok nem redukáló tulajdonságúak, mert funkciós csoportjuk nem tud oxigén felvenni. A ketonok csak nagyon erős oxidálószerekkel oxidálhatók karbonsavakká.A ketonok hidrogénatom felvételével, redukcióval másodrendű alkoholokká alakulhatnak vissza.
Propanon,aceton
Színtelen, jellegzetes szagú, könnyen párolgó folyadék. Szerves vegyületek, festékek, lakkok kiváló oldószere; körömlakklemosó.
Oxigéntartalmú funkciós csoportok: képlet, név, vegyületcsoport neve, példavegyület
Alkoholok, fenolok fogalma, példák
Alkoholok és fenolok elnevezése, alkoholok rendűsége, általános képlete
Kondenzáció és hidrolízis példákkal: észter és éterképzés (etanol + etanol, etanol + ecetsav, etanol+kénsav, salétromsav, zsíralkohol-hidrogénszulfátok szerkezete, felhasználása)
Metanol, etanol égése
Metanol, etanol, propán-1-ol, propán-2-ol, 2-metil-propán-2-ol enyhe oxidációja (CuO-val)
Metanol, etanol + nátrium
Etanol előállítása erjesztéssel és eténből
Fenol + víz, fenol + NaOH, polikondenzáció, bakelit
Fenol + klór
Acetilén vízaddíciója, a termék átrendeződése
Éterek fogalma, dietil-éter előállítása, etil-metil éter előállítása, éterek hidrolízise
Aldehidek és ketonok fogalma, elnevezése, általános képlete
Ezüsttükör próba egyenlete formaldehiddel, acetaldehiddel, acetonnal
Formaldehid vízaddíciója, termék polikondenzációja, formaldehid reakciója metanollal
Ribóz, glükóz és fruktóz gyűrűvé záródása, axiális és ekvatoriális helyzetű csoportok a glükózban
Glikozidos hidroxil csoport fogalma
Szénhidrátok csoportosítása példákkal (oxocsoport, szénatomszám alapján), aldóz, ketóz, trióz, pentóz, hexóz (és ezek kombinációi pl. aldotrióz) fogalma példákkal
optikai izoméria fogalma, izomerek összehasonlítása, opt. izoméria feltétele, konfiguráció, kiralitás centrum, opt. izoméria típusai példákkal (részleges és teljes tükörképi párok), izomerek száma trióz, tetróz, pentóz, hexózoknál
Képletek: metanol, etanol, propán-1-ol, propán-2-ol (izopropanol), 2-metil-propán-2-ol, nagyobb szénatomszámú alkoholok képlete szabályos név alapján, glicerin, glikol, benzil-alkohol, szalicil-alkohol, fenol
dimetil-éter, dietil-éter, etil-metil-éter
formaldehid, acetaldehid, benzaldehid, aceton, nagyobb szénatomszámú oxovegyületek képlete szabályos név alapján
D- és L-GA, DA, ribóz és dezoxi-ribóz, glükóz, fruktóz, galaktóz nyílt és gyűrűs szerkezetben
Hidroxivegyületek
A szerves hidroxivegyületek OH- (hidroxil) csoportot tartalmaznak. Általános összegképletük, R-OH. Ha a hidroxilcsoport telített szénatomhoz kapcsolódik, akkor jönnek létre az alkoholok.
Az alkoholok értékűség szerint lehetnek:
- Egyértékű alkoholok: egyetlen, OH-csoportot tartalmaznak, pl. metanol CH3-OH
- Kétértékű alkoholok: két, OH-csoportot tartalmaznak, pl. glikol HO-CH2-CH2-OH
- Három-, illetve többértékű alkoholok
- Másodrendű alkoholok: jellemző funkciós csoport =CH-OH. A hidroxilcsoport másodrendű szénatomhoz kapcsolódik.
- Elsőrendű alkoholok: jellemző funkciós csoport -CH2-OH. A hidroxilcsoport elsőrendű szénatomhoz kapcsolódik – olyan szénatomhoz, amely csak egyetlen másik szénatomhoz kapcsolódik.
- Harmadrendű alkoholok: jellemző funkciós csoport ºC-OH.