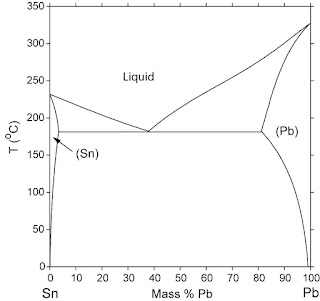
REDOXI ÉS SAV-BÁZIS FOLYAMATOK
Kémiai folyamatok osztályozása
1.) A résztvevő anyagok érintkezési helye szerint
- Homogén reakció
 a folyamatban résztvevő anyagok egy fázisban (gáz vagy folyadék) érintkeznek egymással.
a folyamatban résztvevő anyagok egy fázisban (gáz vagy folyadék) érintkeznek egymással.
- Heterogén reakció
 a résztvevő anyagok csak adott felületen, a fázishatáron érintkeznek egymással.
a résztvevő anyagok csak adott felületen, a fázishatáron érintkeznek egymással.
2.) Energetikai szempontok alapján
- exoterm
- endoterm (ls. Termokémiai fejezet)
3.) Időbeli lejátszódás szerint
- Pillanatszerű
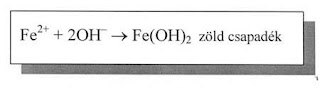
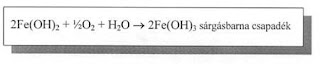
- Ha a csapadékot tartalmazó kémcsövet rázogatjuk és várunk két-három percet, akkor sárgásbarna csapadékot kapunk
 ez tehát lassúbb folyamat.
ez tehát lassúbb folyamat.
- Nagyon lassú folyamatok (pl. a fémek korróziója).
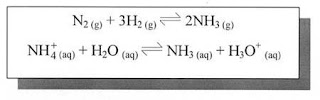
- Végtelen lassú reakciók. A N2 (g) és az O2 (g) szobahőmérsékleten gyakorlatilag nem reagál egymással.
A reakciósebesség jellemzi a reakciók időbeli lefutását (ls. Reakciókinetika c. fejezet)
4.) A kémiai folyamatok iránya szerint
- Egyirányú reakciók*
i) pl. csapadékképződési reakciók: Ag+ (aq) + Cl- (aq)  AgCl (s) fehér csapadék
AgCl (s) fehér csapadék
ii) pl. gázfejlődéssel járó reakciók: 2H+ (aq) + S2- (aq)  H2S (s)
H2S (s)
- Megfordítható reakciók (ls. Egyensúlyok c. fejezet)
*Külső kényszer hatására (pl. nagy nyomás) az egyirányú reakciók ellenkező irányba is végbemehetnek, tehát legalábbis elméletileg minden kémiai reakció megfordítható.
5.) Részecskeátmenet szempontjából
- Protonátmenettel járó reakciók
- Elektronátmenettel járó reakciók
i) Redoxireakciók
ii) Elektrokémiai folyamatok
- Egyéb
6.) Elsősorban szerves kémiai reakciók esetében…
6.1. A reakció eredménye szerint
6.1.1. Szubsztitúció
6.1.2. Addició
6.1.3. Elimináció
6.1.4. Polimerizáció
6.1.5. Kondenzáció stb.
6.2. Elemi lépések szerint
6.2.1. Molekula-
6.2.2. Gyökös-
6.2.3. Ionos reakciók
6.3. Reagens természete szerint
6.3.1. Elektrofil
6.3.2. Nukleofil
Sav-bázis reakciók
Arrhenius szerint…
a savak olyan anyagok, amelyek hidrogénionra (és anionra), a bázisok pedig hidroxidionra (és kationra) disszociálnak vizes oldatban.
Brönsted szerint…
a savak proton leadásra, a bázisok proton felvételére képes anyagok. A Brönsted-féle sav-bázis fogalom magába foglalja az arrheniusi savakat és bázisokat is, de annál széleskörűbben értelmezhető:
- nemcsak vegyületek, hanem ionok is rendelkeznek sav-bázis tulajdonsággal
- nemcsak vizes oldatban értelmezhetők a sav-bázis reakciók
pl. az
NH3 (g) + HCl (g)  NH4Cl (s)
NH4Cl (s) folyamat is annak tekinthető!
Ezen okokból a későbbiekben Brönsted elméletét alkalmazzuk a sav-bázis reakciók értelmezésekor!
Sav-bázis párok
- A sav-bázis fogalom relatív! Egy anyagot csak akkor nevezhetünk savnak vagy bázisnak, ha ismerjük a partnerét, tehát egy anyag csak valamihez képest lehet sav vagy bázis! A leszakadó proton szabadon nem létezhet, tehát egy anyag csak akkor viselkedhet savként, ha van egy másik anyag, amelyik képes megkötni a protont.
- A közhasználatban savnak illetve bázisnak nevezett vegyületek a vízhez viszonyítva savak.
- Egy reakcióban savként viselkedő anyag (pl. HCl) olyan részecskévé (Cl-) alakul, amely a mellette feltüntetett reakciópartnernek (H3O+) a protonját képes felvenni, vagyis bázis. Ez természetesen fordítva is igaz:
| HCl | + | H2O |  | Cl- | + | H3O+ |
| sav1 | | bázis2 | | bázis1 | | sav2 |
A hidrogén-klorid konjugált sav-bázis párja a kloridion, a vízmolekulának az oxóniumion!
Amfoter anyagok
Proton leadásra és felvételre is képesek. Az amfotéria szintén relatív fogalom. A gyakorlatban leginkább a vizes oldatokban amfoterként viselkedő anyagokról beszélünk: ilyen maga a víz, a hidrogéntartalmú összetett anionok (pl. HNO3-), illetve néhány szerves vegyület (pl. az imidazol, az aminosavak stb.). A cseppfolyós ammóniában a vízhez viszonyítva bázisként viselkedő ammónia is amfoterként viselkedik:
NH3 + NH3  NH2- + NH4+
NH2- + NH4+
Erősség
Első megközelítésben azok az erős savak, amelyek könnyen adják át protonjukat, erős bázisok, amelyek könnyen protonálódnak.
A protolítikus reakciók is egyensúlyi reakciók.
Erős savaknak azokat a vegyületeket nevezhetjük, amelyek híg vizes oldatban gyakorlatilag teljesen disszociálnak, vagyis egyensúlyi állandójuk nagy. Ilyenek a szervetlen, ún. ásványi savak között akadnak: HCl, HBr, HI, H2SO4, HNO3, HClO4 stb. {pl. Ks(HNO3)= 1,2}
A gyenge savak híg vizes oldatban sem disszociálnak teljesen.
A disszociációfok (jele:

közötti érték lehet;

)
a hígítással még híg (c < 0,1 mol/dm3) oldatok esetén is nagymértékben nő. Gyenge savak: H2S, az oxósavak közül az alacsonyabb oxidációs számú központi atomot tartalmazó H2SO3, HNO2, HClO2, HOCl stb., valamint a szénsav (H2CO3) és a legtöbb szerves sav (HCOOH, CH3COOH, a fenol stb.).
A saverősséget a savállandóval adhatjuk meg. Egy HA összegképletű savra :
Minél kisebb Ks értéke, annál gyengébb savról van szó.
Erős bázisokat gyakorlatilag csak az ionvegyületek között találunk. Ilyenek az alkálifém-hidroxidok (NaOH, KOH) és a legtöbb alkáliföldfém-hidroxid {Ca(OH)2, Sr(OH)2, Ba(OH)2}, melyek vízben jól oldódnak, az oldódás során teljesen disszociálnak:
NaOH (s)  Na+ (aq) + OH- (aq)
Na+ (aq) + OH- (aq)
Gyenge bázisok egyrészt azok az anyagok, amelyek molekulái közül még híg vizes oldatban sem protonálódik az összes.
NH3 + H2O+  NH4+ + OH-
NH4+ + OH-
A bázis állandó:
Ilyen gyenge bázisok a szerves vegyületek közé tartozó aminok is. A bázisokra is igaz, hogy minél gyengébb bázisról van szó, annál kisebb a bázisállandó értéke. Továbbá gyenge bázisnak tekinthetők a vízben rosszul oldódó, rosszul disszociáló hidroxidok is. Ezek többnyire a közönséges csapadék-ként kiváló vegyületek {pl. Mg(OH)2, Fe(OH)3 stb.}, gyakorlatilag az összes p- és d-mezőbeli fém-hidroxidok.
Kémhatás
A víz autoprotolíziséből
H2O+ H2O  H3O+ + OH-
H3O+ + OH- következően a tiszta víz is tartalmaz oxónium- és hidroxidionokat. Például 25°C-on:
[H3O+]=[OH-]=1·10-7 mol/dm3
Ezek koncentrációját a bevitt savak és bázisok megváltoztatják. A bevitt sav növeli az oxóniumion-koncentrációt, ezzel - a kémiai egyensúly törvénye miatt - csökkenti a víz autoprotolíziséből származó hidroxidion-koncentrációt. A bevitt bázis növeli a hidroxidion-koncentrációt, lúgos kémhatást okoz. Csökkenti a víz autoprotolízisét, és ezzel visszaszorítja az oxóniumionok koncentrációját. A 25°C-on fennálló összefüggés:
Kv= [H3O+]·[OH-]= 1·10-14
Semleges kémhatású oldatban: [H3O+]=[OH-]=1·10-7 mol/dm3,
Savas kémhatású oldatban: [H3O+] > [OH-], így [H3O+] > 1·10-7 mol/dm3,
Lúgos kémhatású oldatban: [H3O+] < [OH-], így [H3O+] < 1·10-7 mol/dm3.
A kémhatás egyszerűbb kifejezésére vezették be a pH fogalmát, amely az oldat oxóniumion-koncentrációjának negatív, tízes alapú logaritmusa:
pKv= pH+ pOH= 14 (25°C-on!)
A különböző kémhatású oldatok pH-ja:
- semleges
 pH = 7
pH = 7
- savas
 pH < 7
pH < 7
- lúgos
 pH > 7
pH > 7
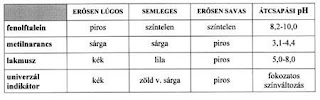
Sav-bázis indikátorok
Maguk is sav-bázis tulajdonságú anyagok, amelyek az oldat kémhatását úgy jelzik, hogy protonleadásuk vagy protonfelvételük után bekövetkező molekulán belüli kötésátrendeződésük színváltozással jár. A színváltozás meghatározott pH-tartományban történik (keverékindikátoroknál a színváltozás folyamatos)!
Sók hidrolízise
Olyan kémiai reakció, amelyben valamilyen só anionja vagy kationja lép protolitikus reakcióba a vízmolekulákkal.
Ha egy erős sav (pl.HCl) a vízzel reakcióba lép, a belőle keletkező bázis (Cl-) a mellette feltüntetett savval (H3O+) szemben igen gyenge bázisként viselkedik
| HCl | + | H2O |  | Cl- | + | H3O+ |
| erős sav1 | | bázis2 | | gyenge bázis1 | | sav2 |
Ebből az is következik, hogy egy, a vízhez képest gyenge savból származó anion az oxónium-ionokkal szemben erős bázisként viselkedik.
| CH3COOH | + | H2O |  | CH3COO- | + | H3O+ |
| gyenge sav1 | | bázis2 | | erős bázis1 | | sav2 |
Ha egy vizes oldatba az erős savból, illetve a gyenge savból származó ion kerül (NaCl, CH3COONa), akkor ezek közül csak a gyenge savból származó anionról feltételezhető, hogy az oxóniumionokhoz képest jóval gyengébb savként viselkedő vízmolekulákkal szemben számottevő bázicitást mutat.
A folyamat egyensúlyi állandója tulajdonképpen a gyenge savból származó anionra vonatkoztatott bázisállandó, amit hidrolízisállandónak is nevezhetünk.
Kh= Kb(CH3COO-)= = 5,6·10-10
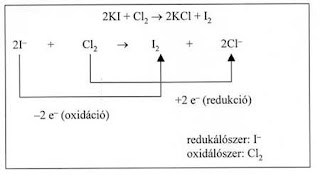
Redoxireakciók
Korábbi felfogás szerint az oxidáció az oxigénnel való egyesülés vagy a hidrogénelvonás (dehidrogénezés), a redukció az oxigén elvonás, illetve a hidrogénnel való egyesülés volt.
Mai felfogásunk szerint az oxidáció elektron leadást, a redukció elektron felvételt jelent. Ez a fogalom a sav-bázis elmélethez hasonlóan magába foglalja az előző, korábban kialakított felfogás szerinti oxidációt és redukciót, de annál bővebb fogalom.
Az oxidáció és a redukció kapcsolata
- két folyamat egymást feltételezi, mert…
- egy anyag csak akkor oxidálódhat, ha a leadott elektronokat egyidejűleg egy másik anyag felveszi, így…
- az oxidáló anyag a reakciópartner redukálószere, illetve a redukáló anyag a reakciópartner oxidálószere
Példák:
a) Két elem reakciója
b) Fémek és fémionok reakciója
c) Nemfém és nemfémből származó ion reakciója
Az oxidáció és redukció fogalmának kiterjesztése kovalens vegyületekre
- A redoxireakciók itt részleges elektronátadással mennek végbe.
- A kötést létesítő atomok közül a nagyobb elektronegativitású közelében nagyobb az elektronsűrűség, mint elemi állapotában, tehát redukáltabb, a kisebb elektronegativitású atom ennek megfelelően az elemi állapothoz viszonyítva oxidáltabb (elektronhiányosabb).
- Az oxidáltság mértékének egyértelműbb meghatározására megalkották az oxidációs szám fogalmát (ls. később).
- Az oxidációs szám növekedése oxidációt, csökkenése redukciót jelent.
Oxidációs szám
- Tényleges vagy névleges (fiktív) töltés, mely az elemi állapothoz viszonyított oxidációs állapotot mutatja meg.
- A fentiek alapján az elemek oxidációs száma mindig 0.
- Ionok (egyszerű ionok, pl. fémionok, oxidionok stb.) oxidációs száma megegyezik a töltéssel. A Na+ oxidációs száma +1, azaz ennyivel oxidáltabb az elemi állapotnál.
- Kovalens vegyületeknél a kötést létesítő elektronpár(oka)t képzeletben a nagyobb elektronegativitású atomhoz rendeljük, és az így kialakult fiktív ionok töltését tekintjük az adott atom oxidációs számának. A vízmolekulában ténylegesen csak részleges negatív töltés van az oxigén atomtörzse körül, mégis az oxidációs szám megállapításának szabályai szerint az O2- és H+ ionok töltése alapján az oxigénnek -2, a hidrogénnek +1 az oxidációs száma.
A kovalens vegyületek oxidációs számának megállapítása
- Az elemek atomjainak oxidációs száma 0.
- A hidrogén oxidációs száma a vegyületekben általában +1. Kivételt képeznek a fém-hidridek, ahol a hidrogén oxidációs száma -1.
- Az oxigén oxidációs száma vegyületekben általában -2. Kivételt képeznek a peroxidok, ahol az oxigén oxidációs száma -1, valamint a F2O
- A vegyületekben a képletben szereplő atomok oxidációs számainak összege 0 (a vegyületek ugyanis semlegesek).
- Az összetett ionokban az oxidációs számok összege az ion töltésszámával egyenlő.
A redoxiegyenletek rendezésekor a leadott és a felvett elektronok mindig megegyeznek, azaz az oxidációsszám-változások összege 0.
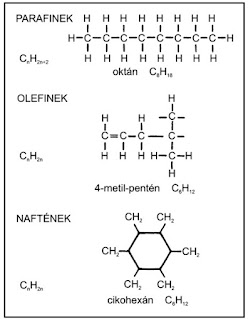
 A normális láncú szénatomok és az alkilcsoportok nevének ismeretében már bonyolult, elágazó láncú szénhidrogéneket is el tudunk nevezni.
A normális láncú szénatomok és az alkilcsoportok nevének ismeretében már bonyolult, elágazó láncú szénhidrogéneket is el tudunk nevezni.