Oxovegyületek
Az oxovegyületeket két csoportra oszthatjuk aszerint, hogy a kettős kötésű oxigénatom - vagyis az OXOCSOPORT - láncvégi vagy láncközi szénatomhoz kapcsolódik-e. A láncvégi szénatomhoz kapcsolódó oxocsoportot tartalmazó vegyületek az ALDEHIDEK, a láncközi vagy gyűrűs szénatomhoz kapcsolódó oxocsoportot tartalmazók pedig a KETONOK.
Az aldehidekre a formilcsoport (aldehidcsoport) illetve a karbonilcsoport, a ketonokra a karbonilcsoport a jellemző, az oxocsoport pedig mindkettőre.
ALDEHIDEK
Funkciós csoport: FORMILCSOPORT (ls. előző ábra).
Elnevezés
- A szisztematikus elnevezés (szubsztitúciós nómenklatúra szabályai szerint) az alap szénhidrogénlánc neve + -al végződés {a formilcsoportokat alkotó szénatomok beleértendők a főláncba} (metanal, etanal, propanal stb.).
- Triviális név: formaldehid, acetaldehid, fahéjaldehid, glicerinaldehid, glioxál…
- Többértékű aldehidek esetén az aldehidcsoport számát a névben jelölni kell (bután-dial).
- Ciklusos aldehidek vagy nyílt láncú polialdehidek elnevezésénél a -karbaldehid utótagot használjuk. Ilyenkor a formilcsoportban szereplő szénatomokat NEM értjük bele a főláncba vagy a gyűrűs szénhidrogénbe (ciklohexán-karbaldehid; 1,3,5-pentántrikarbaldehid)!
- Ha a vegyületben másik, a felsorolásban előnyt élvező csoport van, a formilcsoportot a névben formil-előtaggal jelöljük (3-formil-benzoesav)
Homológsor: létezik. A telített, egyértékű aldehidek homológsorának összegképlete (nyílt lánc esetében): CnH2nO illetve CxH2x+1-COH
Fizikai tulajdonságok
- Hidrogénkötés kialakításában akceptor.
- A legkisebb vegyület standard halmazállapota gáz: formaldehid.
- Olvadás- és forráspontjuk azonos - nem túl nagy - szénatomszám esetén az étereknél és az észtereknél magasabb
lévén erősebben dipólusosak, de nem éri el az alkoholok, fenolok, karbonsavakét (ezek hidrogénkötései erősebbek).
- Nagy szénatomszám esetén a funkciós csoport hatása már elenyésző, ezért a nagy szénatomszámú vegyületek op.-ja jelentősen nem különbözik az azonos C-atomszámú szénhidrogénekétől.
- Vízoldékonyság a kisebb molekulák esetén jó (H-kötés létesítése!), de nem korlátlan [korlátlanul oldódik vízben a formaldehid és az acetaldehid]! A szénatomszám növekedésével nő az apoláros láncrészlet hossza, és ezért egyre rosszabbul oldódnak vízben.
- A kismolekulájú aldehidek szúrós szagúak.
Előállítási módszerek
Primer alkoholokból: 
(Ha nem desztillál át, karbonsavvá alakul.)
(Ha nem desztillál át, karbonsavvá alakul.)
Karbonsav-kloriddal: 
Kémiai tulajdonságok
- Jellemző rájuk a nukleofil addíció (nukleofil reagens: elektrongazdag; kötetlen e-, esetleg ? töltésű)
- Sav-bázis jelleg: vizes oldatának kémhatása semleges.
- Oxidáció: karbonsavvá történik.
- Redukció: az esetek többségében - bár nem kizárólag - a karbonilcsoporton végbemenő addíció! Katalitikus hidrogénezéssel redukálhatók (Pt-katalizátor jelenlétében), ami H addícióját eredményezi a karbonilcsoportra, és a reakció során primer alkohol keletkezik.
- Oxo-enol tautoméria (ls. előző fejezet).
- Biológiailag fontos reakció az ezüsttükör próba:
A reakciót nem adják olyan aldehidek, amelyekben a formilcsoport közvetlenül aromás gyűrűhöz kapcsolódik!!
Fontosabb aldehidek:
- Formaldehid (metanal)
- Acetaldehid (etanal)
- Akrolein (propénal) [Köztitermék az akrilsav propilénből kiinduló előállításánál]
CH2=CH-CHO
- Citrál (izoprénvázas "terpénaldehid")
- Retinal
- Glioxál (1,2-etándial) [Felhasználják műanyagok szintéziséhez]
OHC-CHO
- Glicerinaldehid (biológiai funkció!)
OHC-CHOH-CH2OH
KETONOK
Funkciós csoport: KARBONILCSOPORT
Elnevezés
- A szubsztitúciós nómenklatúra szabályai szerint a ketonokat az -on illetve -keton utótag vagy az oxo- előtag beillesztésével nevezzük el az alapszénhidrogén nevéből kiindulva.
CH3-CO-CH3propanon v. dimetil-keton
CH3-CO-CH2-CH32-butanon v. etil-metil-keton
CH2=CH-CH2-CO-CH34-pentén-2-on v. allil-metil-keton
- A legegyszerűbb ketonnak, a propanonnak triviális neve is van: ACETON.
- A ciklikus ketonok elnevezésénél a ciklo- előtag alkalmazandó; illetve ha a molekulában elsőbbséget élvező csoport van (pl. karboxilcsoport), az oxo- előtag használandó:
Homológsor: létezik. A telített, egyértékű ketonok homológsorának összegképlete (nyílt lánc esetében): CnH2nO (n 3)
3)
Fizikai tulajdonságok
- Hidrogénkötés kialakításában akceptor.
- A legkisebb vegyület standard halmazállapota folyadék (C3 miatt).
- Olvadás- és forráspontjuk azonos - nem túl nagy - szénatomszám esetén az étereknél és az észtereknél magasabb
lévén erősebben dipólusosak. Nagy szénatomszám esetén a funkciós csoport hatása már elenyésző, ezért a nagy szénatomszámú vegyületek op.-ja jelentősen nem különbözik az azonos C-atomszámú szénhidrogénekétől.
- Vízoldékonyság a kisebb molekulák esetén: az aceton korlátlanul, a 4-szénatomos már erősen korlátozottan oldódik.
- A kismolekulájú vegyületek jellegzetes, édeskés szagúak.
Előállítási módszerek
Kémiai tulajdonságok
- Jellemző a nukleofil addíció.
- Sav-bázis tulajdonság: vizes oldatának kémhatása semleges.
- Oxidáció: csak erélyes körülmények esetén, lánchasadással következik be.
- Redukció: az esetek többségében - bár nem kizárólag - a karbonilcsoporton végbemenő addíció! Katalitikus hidrogénezéssel redukálhatók (Pt-katalizátor jelenlétében), ami H addícióját eredményezi a karbonilcsoportra, és a reakció során szekunder alkohol keletkezik. (Ha az oxovegyületek katalitikus hidrogénezését fölös ammónia jelenlétében, magasabb hőmérsékleten és nyomáson végzik, alkohol helyett primer amin képződik [ún. "reduktív aminálás"]
Fontosabb ketonok
- Aceton (propanon, dimetil-keton).
- Kámfor (izoprénvázas keton).
- 1,2-benzokinon (o-benzokinon)
- 1,4-benzokinon (p-benzokinon)
KARBONSAVAK ÉS ÉSZTEREK
Ha egy molekulán belül különböző kötésmódú oxigénatomok különböző szénatomhoz kapcsolódnak, akkor általában ugyanolyan sajátságokat hordoznak a vegyületek, mintha külön-külön volnának jelen. De ha a két különböző funkciós csoport azonos szénatomhoz kapcsolódik, olyan sajátságok lépnek fel, amelyek külön-külön egyik csoportra sem jellemzők. Ezért az ilyen molekula részleteket célszerű egyetlen egységnek, összetett funkciós csoportnak tekintenünk. Az azonos szénatomhoz kapcsolódó oxo- és hidroxilcsoportból felépülő összetett funkciós csoport a karboxilcsoport, az azonos szénatomhoz kapcsolódó oxo- és étercsoportból felépülő pedig az észtercsoport.
KARBONSAVAK
Funkciós csoport: KARBOXILCSOPORT  -COOH
-COOH
Elnevezés
- Triviális név: benzoesav, ecetsav, citromsav stb.
- Régi rendszer: az alap szénhidrogénlácból képzi a nevet, amelyhez a -sav, illetve a -disav utótagot illeszti; a szénláncba a karboxilcsoport szénatomját beleszámolja, a szénatomokat görög betűvel jelöli úgy, hogy a karboxilcsoport melletti szénatom jele a, a mellette levő b, és így tovább:
- IUPAC nómenklatúra: az alap szénhidrogénlácból képzi a nevet, amelyhez a -sav, illetve a -disav utótagot illeszti; a szénláncba a karboxilcsoport szénatomját beleszámolja, a főlánc számozását a karboxilcsoport szénatomjával kezdi!
- Ha a nyíltláncú karbonsav három vagy annál több karboxilcsoportot tartalmaz, a vegyület nevét a -karbonsav utótaggal képezzük, ilyenkor a karboxilcsoportok szénatomjait NEM számoljuk bele a főláncba!
- A gyűrűs karbonsavak elnevezése is a -karbonsav utótaggal történik.
Homológsor: létezik. A telített, egyértékű karbonsavak homológsorának összegképlete (nyílt lánc esetében): CnH2nO2 v. Cx2x+1-COOH
Csoportosítás
- Karboxilcsoportok száma szerint: mono-, di-, trikarbonsav stb.
- A szénhidrogénlánc minősége szerint
- alifás karbonsavak (nyílt láncú)
- alliciklikus karbonsavak (ciklohexán-karbonsav)
- telítetlen karbonsav (R-CH=CH-COOH)
- aromás karbonsav (C6H5-COOH
benzoesav)
- alifás karbonsavak (nyílt láncú)
Fizikai tulajdonságok
- Hidrogénkötés kialakításában donor és akceptor is lehet
- A legkisebb vegyület standard halmazállapota folyadék (HCOOH); a legkisebb dikarbonsav szilárd (HOOC-COOH)
- Olvadás- és forráspont (nem túl nagy szénatomszám esetén): magas (nagyfokú dimerizálódás!
H-kötés). A dikarbonsavak több molekulája asszociálódik, ezeknek még a dioloknál is magasabb az op.-ja. (Nagy szénatomszám esetén a funkciós csoport hatása már elenyésző, ezért a nagy szénatomszámú vegyületek op.-ja jelentősen nem különbözik az azonos C-atomszámú szénhidrogénekétől.)
- Vízoldékonyság a kisebb molekulák esetén: korlátlan (C1-C3); a dikarbonsavak rosszabbul.
- A kismolekulájú vegyületek - C1-C3 - savanyú, szúrós; C4 bűzös szagúak; a nem illékonyak szagtalanok.
Előállítási módszerek
- Alkánok oxidációja (ipari):
- Alkének oxidációja:
- Benzol homológokból:
- Alkoholok oxidációjával:
- Primer alkoholokból:
- Szekunder alkoholokból:
- Karbonsav-észterek hidrolízisével:
Kémiai tulajdonságok
- Sav-bázis jelleg: a vízhez viszonyítva savak. A szubsztituensek hatással vannak a savi erősségre. Ezek egy-két atomnyi távolságban hatnak, ha a szubsztituens elektronszívó (pl. halogén), a proton leadásakor keletkező aniont stabilizálja, és így növeli a savi erősséget! Így például a triklór-ecetsav az erős ásványi savak erősségével vetekszik.
- NaOH-dal, NaHCO3-tal és Na-mal is reakcióba lép.
- Oxidáció (szelektíven a funkcióscsoport szénatomját tekintve): általában csak erélyes körülmények között zajlik le.
- Kémiai reakciók:
Fontosabb karbonsavak:
- hangyasav (metánsav)
- ecetsav (etánsav)
- vajsav (butánsav)
- valeriánsav (pentásav)
- palmitinsav
- sztearinsav
- olajsav
- akrilsav (propénsav)
- benzoesav
- oxálsav (etándisav)
ÉSZTEREK
Nevezéktan
Az észtereket úgy nevezzük el, mint a karbonsavak olyan származékait, amelyekben a karboxilcsoport hidrogénatomját szénhidrogéncsoport helyettesíti, vagyis amelyekben egy szénhidrogéncsoport kapcsolódik egy savmaradékhoz. Az alkánsavakból levezethető alkil-észterek típusneve tehát alkil-alkanoát.
Homológsor: A telített, egyértékű észterek homológsorának összegképlete CnH2nO2 (n 3).
3).
Fizikai tulajdonságok
- Hidrogénkötés kialakításában akceptor.
- A legkisebb vegyület standard halmazállapota folyadék (metil-formiát).
- Olvadás- és forráspont azonos (nem túl nagy szénatomszám esetén) az éterekénél magasabb (lévén gyenge dipólus-dipólus kölcsönhatás).
- Vízoldékonyság a kisebb molekulák esetén nem jó.
- A kismolekulájú vegyületeknél: különböző gyümölcsaromák (a nagy szénatomszámú, nem illékony képviselőik szagtalanok).
Kémiai tulajdonságok
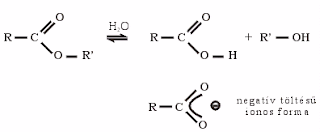
- Sav-bázis jelleg: A vizes oldat kémhatása semleges, hidrolízis esetén gyengén savas.
- Hidrolízis: lúgos közegben az észterek karbonsavra és alkoholra hidrolizálnak! Mivel a közeg lúgos, ezért a sav ionos formában lesz jelen a hidrolízis után:
A hidrolízis során tehát gyakorlatilag sót (a karbonsav nátrium sóját) és alkoholt kaptunk. Ha a karbonsav sójának R-csoportja (alkil-csoport) nagy, úgy szappanokról beszélünk. Az észterek lúgos hidrolízisét szappanosításnak nevezzük.
- Oxidáció: csak erélyes körülmények között megy végbe.
- Ammóniával és aminokkal amidokat képeznek, ugyanis a reakció során karbonsav-amid (ls. ábra) és alkohol keletkezik. A folyamat hasonló, mint az észterhidrolízis, csak mivel az amid stabilisabb, mint az észter, az egyensúly gyakorlatilag teljesen az amidképzés irányába tolódik el.
Fontosabb észterek
- Zsírok és olajok (trigliceridek)
Az acilező savak mindig páros szénatomszámúak, leggyakrabban OLAJSAV, PALMITINSAV, SZTEARINSAV. Az alkohol pedig a GLICERIN.
- Foszfatidok
- Gyümölcsészterek
Kis szénatomszámú alkánsavak egyszerű alkilésztere.
- Viaszok
Nagy és páros szénatomszámú, normál láncú, telített karbonsavak és ugyanilyen típusú alkoholok észterei! (pl. méhviasz)
(A karbonsavakra és az észterekre vonatkozó feladatokat a következő fejezet elején találhatod meg.)




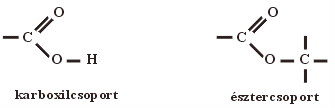


Megjegyzés küldése