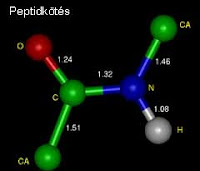
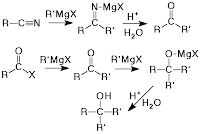
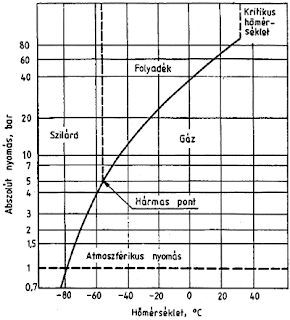
.Értelmezzük a vizes oldatok kémhatását az ionkoncentrációkkal! Mi a vízionszorzat és mekkora az értéke?
A kémiai gyakorlatban igen fontos a víz autodisszociációja (magától végbemenő ionokra bomlása): H2O <-> H+ +OH-
A hidrogén és hidroxidionok koncentrációjának szorzata adott hőfokon állandó érték, ezt nevezik a víz ionszorzatának.
K=[H+]x[OH-]
E szorzat bármely vizes oldatban állandó, és lehetővé teszi, hogy nem csak
savoldatok H+-koncentrációját, ill. pH-ját, hanem lúgoldatok OH- -koncentrációjának ismeretében azok pH-ját is kiszámoljuk.
A tiszta víz ionkoncentrációi tehát 25°C-on:[H+]=[OH-]=10-7mól/dm3
A vizes oldatok hidrogén, ill. [OH-]-koncentrációját a gyakorlatban nem a (mól/dm3)-koncentrációval, hanem annak negatív logaritmusával, a pH-val ,ill. pOH-val adjuk meg.
pH=-lg[H+] pOH=-lg[OH-]
Ezek értéke vízre:pH=pOH=7,0
Savas oldatokra: pH <7>
Lúgos oldatokra: pH> 7> pOH
És a kettő közötti összefüggés 25°C-on minden híg vizes oldatra: pH+pOH=14 (Minél savasabb egy oldat, annál kisebb a pH-ja, minél lúgosabb egy oldat, annál nagyobb a pH-ja.)
2.Miért és hogyan változik meg a víz kémhatása, ha a) salétromsavat, b) NaOH-t oldunk benne?
H2O +HNO3 = H3O+ + NO3-
Az oxóniumionok túlsúlya miatta kémhatás savas lesz. Vegyünk 1 dm3 oldatot, ebben 0,01 mól HNO3 van
oldott állapotban. [H+]=0,01 mól/dm3 pH= -lg[H+]=-lg 0,01=2,0
b)NaOH = Na+ +OH- A hidroxidionok túlsúlya miatt az oldat kémhatása lúgos lesz. Vegyünk 1 dm3 oldatot, ebben 0,01 mól NaOH van oldott állapotban. [OH-]= 0,01 mól/dm3
pOH= - lg[OH-]=2 --- pH=14-2=12
3. A sók egy része vízben oldva kémhatásváltozást okoz.
a, Na2Co3 – lúgos NH4Cl – savas
b, NaCO3 ® 2Na++CO CO
CO +H2O<->HCO
+H2O<->HCO +OH- - lúgos kémhatású
+OH- - lúgos kémhatású
NH4Cl ®NH +Cl+ NH
+Cl+ NH +H2O<->NH3+H3O+ - savas kémhatsú
+H2O<->NH3+H3O+ - savas kémhatsú
A sók hidrolízisekor a vizmolekulákból származó H+ megkötése következtében az a sav és a bázis keletkezik amelyik a sót létrehozta.
4. Hogyan mutatható ki a vizes oldatok kémhatása?
A pH-mérésére szolgálnak az indikátorok, melyek azok a természetes (pl. lakmusz )
vagy mesterségesen előállított ( pl. metilnarancs ) gyengén savas vagy lúgos jellegű szerves vegyületek, amelyeknek disszociációja színváltozással jár.
Indikátor Savban Lúgban
Lakmusz vörös kék
Fenolftalein színtelen vörös
A pH közelítő pontosságú, gyors meghatározására alkalmasak az ún. univerzál indikátorok. Az univerzál indikátor különböző átcsapási pH-jú indikátorok keverékéből áll, minél több különböző átcsapási pH.jú anyag van benne, annál több pH-változást fog színváltozás alapján jelezni. Az univerzál indikátor forgalomba kerül oldat ill. indikátorpapír formájában. Mindkét esetben mellékelt, pontosan kalibrált színskála segítségével az oldatok pH-ja elég pontosan meghatározható.
5. Milyen szerepe van a kémhatásnak a biológiai folyamatokban?
Az emberi szervezet sejtjeiben és vérében a kémhatás enyhén lúgos, pH=7,40 (+- 0,02). Ettől az értéktől 0,4 eltérés már biztosan halálos. Az enzimek működéséhez optimális pH szükséges. A gyomor nyálkahártyájának fedősejtjei sósavat termelnek, így a gyomornedv kémhatása 1-2 –es pH-jú. A lizoszómák belsejében is savas a kémhatás, így el tudják pusztítani az endocitózissal bekerült kórokozókat. A hüvelyben élő tejsavtermelő baktériumok által létrehozott savas kémhatás megakadályozza a hüvelyben a kórokozó baktériumok és gombák elszaporodását
 A klór a periódusos rendszer egy kémiai eleme. Vegyjele Cl, rendszáma 17. A VII. főcsoportba, a halogének közé tartozik. Erősen mérgező, szúrós szagú, zöld színű gáz, melyet kétatomos klórmolekulák (Cl2) alkotnak. Reakciókészsége nagy, csaknem minden elemmel reagál. Vegyértékelektronszerkezete : 3s2, 3p5. Oxidációs száma -1
A klór a periódusos rendszer egy kémiai eleme. Vegyjele Cl, rendszáma 17. A VII. főcsoportba, a halogének közé tartozik. Erősen mérgező, szúrós szagú, zöld színű gáz, melyet kétatomos klórmolekulák (Cl2) alkotnak. Reakciókészsége nagy, csaknem minden elemmel reagál. Vegyértékelektronszerkezete : 3s2, 3p5. Oxidációs száma -1 Molekulaszerkezete lineáris, molekulapolaritása apoláris, molekularács jellemző rá. A levegőnél nagyobb sűrűségű, apoláris jellege miatt apoláris oldószerekben jól oldódik. Vízben is viszonylag jól oldódik, mert kémiai reakció megy végbe. A klór erős oxidálószer, fertőtlenítő hatása baktériumölő tulajdonságán alapul, amelyet először Semmelweis Ignác magyar szülészorvos alkalmazott eredményesen a gyermekágyi láz visszaszorításában.
Molekulaszerkezete lineáris, molekulapolaritása apoláris, molekularács jellemző rá. A levegőnél nagyobb sűrűségű, apoláris jellege miatt apoláris oldószerekben jól oldódik. Vízben is viszonylag jól oldódik, mert kémiai reakció megy végbe. A klór erős oxidálószer, fertőtlenítő hatása baktériumölő tulajdonságán alapul, amelyet először Semmelweis Ignác magyar szülészorvos alkalmazott eredményesen a gyermekágyi láz visszaszorításában. A szervetlen kémia a kémia egyik jelentős ága, mely a szervetlen vegyületek tulajdonságaival és reakcióival foglalkozik. Általánosságban szervetlen vegyületek azok az anyagok, melyek nem tartoznak a szerves kémia hatáskörébe, azaz minden olyan vegyület, mely nem tartalmaz szén-szén, illetve szén-hidrogén kötéseket. Ilyenformán tehát a fentieken kívül a periódusos rendszer minden eleme és azok vegyületei a szervetlen kémia tárgykörébe tartoznak.
A szervetlen kémia a kémia egyik jelentős ága, mely a szervetlen vegyületek tulajdonságaival és reakcióival foglalkozik. Általánosságban szervetlen vegyületek azok az anyagok, melyek nem tartoznak a szerves kémia hatáskörébe, azaz minden olyan vegyület, mely nem tartalmaz szén-szén, illetve szén-hidrogén kötéseket. Ilyenformán tehát a fentieken kívül a periódusos rendszer minden eleme és azok vegyületei a szervetlen kémia tárgykörébe tartoznak.